Prova de Vestibular FGV-SP 2024 (Economia) com Gabarito
Prova de Vestibular FGV-SP 2024 (Economia) com Gabarito
PROVA OBJETIVA
BIOLOGIA
QUESTÃO 01
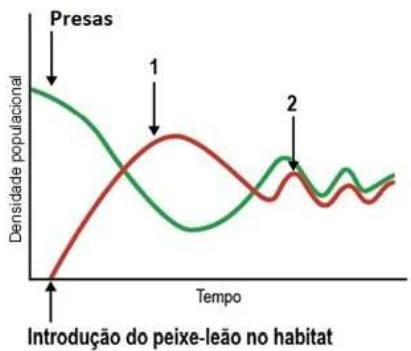
FGV-SP: A crescente presença na costa brasileira do peixe-leão (Pterois volitans), uma espécie invasora, tem causado preocupação junto aos pesquisadores. Estudos demonstram que o peixe-leão eliminou até 95% dos peixes nativos em algumas partes do Oceano Atlântico.
Porém, uma pesquisa recente realizada por duas universidades norteamericanas mostrou que ainda há esperança. Usando modelos matemáticos, os pesquisadores conseguiram determinar exatamente qual porcentagem de peixes-leão em determinado habitat precisa ser removida através da caça, para que as populações de peixes nativos, presas do peixe-leão, se recomponham.
Os resultados obtidos com os modelos matemáticos estão mostrados a seguir.
A interpretação do gráfico permite concluir que
A) a população de peixes-leão determina a densidade da população de presas, mas a densidade da população de presas não influencia a densidade da população de peixes-leão.
B) o decréscimo na população de presas, observado no ponto 2, tem como consequência o aumento da população de predadores.
C) o aumento da população de predadores sempre ocorre antes do aumento da população de presas e está relacionado ao fato das populações terem alcançado o equilíbrio dinâmico.
D) a remoção de parte da população de peixes-leão eliminou a resistência do meio, levando ao aumento do tamanho da população de presas ao longo do tempo.
E) a remoção parcial de peixes-leão (ponto 1) do habitat determina, após algum tempo, o estabelecimento de um equilíbrio dinâmico entre as populações de presa e predador.
QUESTÃO 02
FGV-SP: Ao longo da história da biologia, observam-se diversas mudanças em relação à classificação dos organismos, pois, conforme uma nova informação é descoberta, novos parâmetros são utilizados.
Assim, o sistema de classificação dos seres vivos em cinco reinos - Monera, Protista, Plantae, Fungi e Animalia – foi recentemente substituído pelo sistema de três domínios - Archaea, Bacteria e Eukarya.
Esse sistema foi proposto por Carl Woese na década de 1970 e agrupa os organismos a partir da análise comparativa da sequência de bases de seu RNA ribossômico.
Em relação aos sistemas de classificação acima citados, é correto afirmar que
A) os vírus possuem estrutura muito simples e primitiva, sendo por isso classificados no domínio Archaea.
B) os domínios Bacteria e Archaea incluem apenas organismos procariontes e unicelulares.
C) as arqueias possuem maior grau de parentesco evolutivo com bactérias do que com os unicelulares do domínio Eukarya.
D) o domínio Bacteria é formado por organismos uni ou pluricelulares, autótrofos ou heterótrofos.
E) os protistas não formam um grupo monofilético e estão divididos nos domínios Archaea e Eukarya.
QUESTÃO 03
FGV-SP: Observe a fotografia do tronco de uma árvore.
Crescendo sobre esse tronco, observam-se
A) espécimes de vegetais parasitas que exercem o papel de consumidores secundários.
B) estruturas reprodutoras de um vegetal onde estão guardadas as sementes.
C) plantas epífitas que crescem sobre outras, nutrindo-se da planta hospedeira.
D) corpos de frutificação, estruturas produtoras de esporos de certos tipos de fungos.
E) organismos que ocupam o primeiro nível trófico nas cadeias alimentares.
QUESTÃO 04
FGV-SP: Entre os diversos setores para os quais o nitrogênio é importante, está a agricultura, que é também o que mais interfere no ciclo do elemento na Terra em função do amplo uso de fertilizantes. Como uma verdadeira commodity, o nitrogênio é ofertado de maneira desigual entre países ricos e pobres, sendo usado em grandes quantidades por alguns, e, por outro lado, estando escasso em outras partes do mundo, atrasando o desenvolvimento da produção de alimentos de diversas nações.
(Diego Freire. Agência FAPESP. https://agencia.fapesp.br/. Adaptado.)
Sobre o ciclo do nitrogênio, é correto afirmar que
A) as plantas absorvem o nitrogênio atmosférico para produzir suas próprias proteínas que, por sua vez, poderão ser consumidas pelos animais.
B) bactérias decompositoras do gênero Rhizobium, em associação com raízes de leguminosas, aumentam o teor de nitrogênio no solo, constituindo uma forma de adubação.
C) o uso excessivo de fertilizantes sintéticos, ricos em nitrogênio, pode causar a contaminação do solo e dos ecossistemas aquáticos.
D) as bactérias e fungos decompositores são responsáveis por transformar os compostos orgânicos nitrogenados em nitrogênio gasoso, que retorna para a atmosfera.
E) o nitrogênio inorgânico (amônia) é convertido em nitrogênio orgânico através do processo de fixação, realizado por bactérias do solo.
QUESTÃO 05
FGV-SP: O esquema mostra mecanismos de passagem de substâncias através da membrana de uma célula.
A passagem de ________ através da membrana plasmática é feita por ____________, como representado pela(s) letra(s) _____.
As lacunas devem ser corretamente preenchidas por:
A) gás oxigênio; difusão simples; A.
B) proteínas; transporte passivo; B e C.
C) aminoácidos; transporte ativo; C
D) íons sódio; osmose; A e C.
E) glicose; transporte ativo; B.
QUESTÃO 06
FGV-SP: Em fevereiro deste ano, um inseto infectado com o protozoário Trypanosoma cruzi foi encontrado na cidade de São Paulo em um domicílio na zona sul da capital. O microrganismo é causador da doença de Chagas que, quando não tratada adequadamente, pode causar insuficiência cardíaca e problemas em órgãos do trato digestivo.
Pesquisas recentes têm apontado que as espécies hospedeiras do protozoário têm migrado do ambiente silvestre para o urbano, aumentando assim o risco da exposição da população à doença. A Secretaria Municipal de Saúde (SMS) destacou que não há registro de transmissão de doença de Chagas na grande São Paulo. No entanto, como medida preventiva e que visa fortalecer a vigilância da doença, a Secretaria recomenda que, em caso de possível presença do vetor, a população capture e entregue o inseto na Unidade de Vigilância em Saúde mais próxima.
(Fonte: https://jornal.unesp.br/2023/02/03/vigilancia-sanitaria-
encontra-na-zona-sul-desao-paulo-inseto-transmissor-da-doenca-de-chagas/. Adaptado)
Uma das formas de profilaxia para a doença de Chagas é o combate ao principal inseto vetor, que é o(a)
A) carrapato-estrela (Amblyomma cajennense).
B) barbeiro (Triatoma infestans).
C) fêmea do mosquito palha (birigui).
D) fêmea do mosquito Anopheles.
E) fêmea do mosquito Aedes aegypti.
QUESTÃO 07
FGV-SP: O sistema digestório de vertebrados é uma “linha de desmontagem”. Nele, uma variedade de processos químicos e físicos ocorrem em diferentes órgãos, contribuindo para quebrar eficientemente o alimento em substâncias que o corpo consegue utilizar.
No sistema digestório humano,
A) o suco pancreático contém substâncias que emulsionam as gorduras.
B) a digestão das proteínas inicia-se no estômago.
C) os lipídios são digeridos no intestino delgado por ação das enzimas da bile.
D) o bolo alimentar segue do intestino grosso em direção ao intestino delgado.
E) as fibras alimentares são absorvidas juntamente com a água no intestino grosso.
QUESTÃO 08
FGV-SP: Um experimento pode ser usado para identificar a preferência de microrganismos pela disponibilidade de oxigênio molecular (O2). Nele, tubos de ensaio são preenchidos com caldo de tioglicolato (um meio de cultura caracterizado pela ausência total de oxigênio molecular) e fechados com algodão.
Isso permite a difusão de O2 atmosférico para o interior dos tubos de ensaio, gerando um gradiente na concentração de oxigênio molecular dentro do tubo.
O esquema a seguir mostra o resultado do experimento realizado com diferentes espécies de bactérias.
Associe cada uma das descrições abaixo a um dos tubos de ensaio A, B, C, D ou E.
( ) Bactérias aeróbias obrigatórias – utilizam apenas o O2 como aceptor final de elétrons no processo de obtenção de energia, realizam respiração celular.
( ) Bactérias anaeróbicas aerotolerantes - podem crescer em presença de oxigênio molecular mas não utilizam esse gás para obtenção de energia, pois são organismos fermentadores.
( ) Bactérias anaeróbias obrigatórias - não sobrevivem em presença de O2, pois não possuem enzimas que neutralizam as formas tóxicas de oxigênio.
( ) Bactérias microaerófilas – precisam do O2, mas não toleram a pressão parcial do oxigênio na atmosfera, crescem somente em concentrações de oxigênio inferiores à do ar.
( ) Bactérias anaeróbias facultativas - realizam a respiração celular em presença de O2, mas realizam a fermentação ou a respiração anaeróbica quando o oxigênio não está disponível, ainda que a eficiência energética desses dois processos seja reduzida.
Assinale a opção que indica a sequência correta, de cima para baixo.
A) A, C, B, E e D.
B) B, E, A, B e C.
C) E, C, B, A e D.
D) B, D, C, A e E.
E) D, C , A, E e B.
QUESTÃO 09
FGV-SP: Em determinadas aves, o alelo dominante (M) codifica o tamanho de bico grande e o alelo recessivo (m) codifica o tamanho de bico pequeno.
Os bicos dos indivíduos heterozigotos têm tamanho médio. Considerando que uma população dessas aves está em equilíbrio de Hardy-Weinberg e que a frequência do alelo dominante é 0,3, a frequência de heterozigotos na população é
A) 1
B) 0,2
C) 0,42
D) 0,21
E) 0,49
QUESTÃO 10
FGV-SP: Um geneticista interessado em compreender a herança dos genes B e Q cruzou indivíduos heterozigotos para os dois genes com indivíduos duplamente homozigotos recessivos. Na geração F1, foram obtidos
como resultado os seguintes números de indivíduos:
Considerando que o tamanho da amostra era adequado à pesquisa em questão, o geneticista concluiu que o mecanismo de herança destes genes era um caso
A) regido pela Segunda Lei de Mendel, sendo 82% a frequência de indivíduos homozigotos na F1.
B) de genes ligados, sendo a taxa de permutação de 9% e a distância entre os genes de 18 UR.
C) regido pela Segunda Lei de Mendel, sendo que 25% dos gametas produzidos pelos indivíduos parentais heterozigotos são BQ.
D) de genes ligados, sendo a taxa de permutação de 18% e a distância entre os genes de 18 UR.
E) de genes ligados, sendo a taxa de permutação de 9% e a distância entre os genes de 82 UR.
QUESTÃO 11
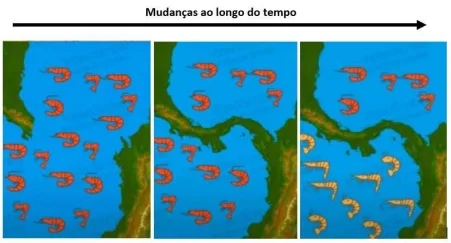
FGV-SP: Em eras passadas, nos mares onde hoje é a América Central, era encontrada uma espécie de camarão. Quando o istmo entre as Américas do Norte e do Sul se formou, separando o golfo do México do oceano Pacífico, as duas populações, submetidas a condições diferentes, originaram espécies distintas. Veja a ilustração a seguir.
A diferenciação das populações dos crustáceos em questão em duas espécies se deu pelo(a)
A) acúmulo de mudanças genéticas devido à seleção, resultando em especiação simpátrica.
B) fluxo gênico que ocorreu entre as duas populações de crustáceos, resultando em um caso de especiação alopátrica.
C) isolamento reprodutivo das duas populações de crustáceos, resultando em especiação simpátrica.
D) deriva genética e por mutações aleatórias que, eventualmente, levaram à especiação simpátrica.
E) surgimento da barreira geográfica que impediu a troca de genes entre as populações, sendo este um caso de especiação alopátrica.
QUESTÃO 12
FGV-SP: A ovulogênese humana, processo que cria os gametas femininos, é interrompida na prófase I, sendo a divisão celular retomada na puberdade. Assim, uma menina, por volta de seus 5 anos, tem, em seus(suas)
A) ovócitos primários, 46 cromossomos, pois estes são células diploides.
B) ovótides, 23 cromossomos, pois estas são células diploides.
C) ovócitos primários, 23 cromossomos, pois estes são células diploides.
D) ovótides, 46 cromossomos, pois estas são células haploides.
E) ovócitos primários, 23 cromossomos, pois estes são células haploides.
QUESTÃO 13
Observe o gráfico a seguir:
FGV-SP: O comprimento de onda da luz de menor importância para a fotossíntese é o que corresponde à (s) cor(es)
A) azul, o que justifica o fato de não enxergarmos os eucariontes fotossintetizantes dessa cor.
B) verde, o que justifica o fato de nem todos os eucariontes fotossintetizantes apresentarem essa cor.
C) vermelho, o que justifica ser essa cor comum nas pétalas das flores de angiospermas, mas incomum em folhas.
D) verde, o que justifica o fato da maioria dos eucariontes fotossintetizantes apresentarem essa cor.
E) azul e vermelho, o que justifica serem essas cores comuns nas pétalas das flores de angiospermas, mas incomuns em folhas.
QUESTÃO 14
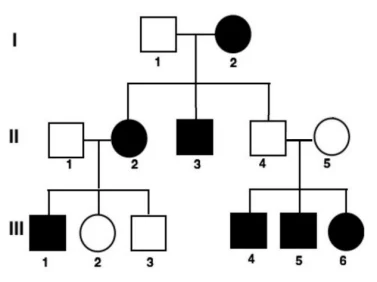
FGV-SP: Na espécie humana, a característica lóbulos de orelha presos ou soltos é determinada geneticamente. No heredograma a seguir, os quadrados e círculos pretos correspondem ao fenótipo lóbulos de orelha presos; quadrados e círculos brancos correspondem ao fenótipo lóbulos soltos.
Se uma criança nasce da união entre a mulher III-2 e seu primo III-4, a probabilidade de que seja uma menina com lóbulos de orelha presos é:
A) 2/3
B) 1/3
C) 1/4
D) 3/4
E) 1/2
FGV-SP - QUESTÃO 15 - ANULADA.
FÍSICA
QUESTÃO 16
FGV-SP: Uma onda eletromagnética de 60 Hz, frequência da rede doméstica, se propaga no ar. Seu comprimento de onda tem a ordem de grandeza
A) da distância do Sol à Terra.
B) da altura de um prédio de oito andares.
C) do raio do planeta Terra.
D) do raio de uma bola de vôlei.
E) do raio de uma bolinha de gude.
Dado:
Velocidade de propagação da luz no ar = 3 x 10⁸ m/s.
QUESTÃO 17
FGV-SP: Um raio de luzmonocromática se propaga no ar e incide em um espelho plano cuja normal forma um ângulo de 41° com sua direção de propagação. A luz refletida atinge a face plana de um bloco de vidro perpendicular ao espelho. O ângulo de refração da luz no vidro é
A) 41°.
B) 26°.
C) 22°.
D) 30°.
E) 49°.
Dados:
Índice de refração do ar =1
Índice de refração do vidro = 1,5
sen 22°= 0,37
sen 26°= 0,44
sen 30°= 0,50
sen 41°= 0,66
sen 49° = 0,75
QUESTÃO 18
FGV-SP: Um recipiente cilíndrico contendo água tem raio interno de 2 cm. Um objeto metálico de 270 g, feito de um único material, é totalmente mergulhado na água cujo nível sobe 2 cm. Dentre os metais abaixo, qualpode ser o material de que é feito o objeto?
A) Prata.
B) Cobre.
C) Alumínio.
D) Ferro.
E) Chumbo.
Considere: π = 3
Dados: densidades (em g/cm³) de
água = 1
alumínio = 2,7
ferro = 7,9
cobre = 8,9
prata = 10,5
chumbo = 11,3
QUESTÃO 19
FGV-SP: Um carrinho de brinquedo desliza, sem atrito e em linha reta, sobre um plano horizontal, com velocidade 3 m/s. O carrinho tem um dispositivo com uma mola comprimida sobre a qual está uma bolinha.
Num dado instante a mola é solta, a bolinha é lançada verticalmente para cima com velocidade vertical igual a 4 m/s e o carrinho, sem parar, segue com velocidade 3 m/s, na horizontal. A altura máxima atingida pela bolinha e a posição em que ela cai, em relação ao carrinho, são respectivamente:
A) 1,25 m, atrás do carrinho.
B) 0,8 m, sobre o carrinho.
C) 1,25 m, sobre o carrinho.
D) 0,8 m, atrás do carrinho.
E) 1,25 m, na frente do carrinho.
Dado: aceleração da gravidade local = 10 m/s².
Observação: despreze a resistência do ar.
QUESTÃO 20
FGV-SP: No modelo de Bohr, o átomo de hidrogênio no estado fundamental é tratado como um próton em torno do qual um elétron executa movimento circular uniforme de raio a. A força entre o próton e o elétron é a de Coulomb.
O valor da soma E das energias cinética e potencial do sistema é, aproximadamente,
A) – 2,3 x 10⁻¹⁸ J.
B) + 2,3 x 10⁻¹⁸ J.
C) – 0,5 x 10⁻¹⁸ J.
D) + 0,5 x 10⁻¹⁸ J.
E) – 1,0 x 10⁻¹⁸ J.

QUESTÃO 21
FGV-SP: Duas placas metálicas planas, paralelas e circulares, de raio R, distam d uma da outra, sendo d << R. As placas estão carregadas com cargas +Q e -Q. A figura esquemática ilustra o sistema, sendo x̂, ŷ e ẑ os versores nas direções x, y e z, respectivamente. As superfícies equipotenciais entre as placas são planos paralelos a elas e a diferença de potencial entre superfícies, separadas por 1 mm, é 4 V.
O campo elétrico  entre as placas é
entre as placas é
A) uniforme e igual a (+ 4 kV/m) ẑ.
B) uniforme e igual a (– 4 kV/m) ẑ.
C) uniforme e igual a (– 4 V/m) x̂.
D) uniforme e igual a (+ 4 V/m) ŷ.
E) (+ 4 kV/m) ẑ nas proximidades da placa superior e sua intensidade decresce com z.
QUESTÃO 22
FGV-SP: Quatro cargas puntiformes, +q, –2q, –q, +2q, sendo q > 0, estão fixas, respectivamente, nas posições (−d,−d) , (2d,−2d), (−d,d) e (2d, 2d) do plano, com d > 0. Num certo instante um elétron se encontra na origem do sistema de coordenadas. O campo elétrico  na origem (de módulo E) e a aceleração
na origem (de módulo E) e a aceleração  deste elétron (de móduloa) nesse instante são dados por:
deste elétron (de móduloa) nesse instante são dados por:

Observação:
x̂ e ŷ são, respectivamente, os versores paralelos aos eixos x e y
QUESTÃO 23
FGV-SP: Um atleta de 70 kg sobe, pelas escadas, 10 andares de um prédio, cada um deles com 3 m de altura, em 42 s. A potência por ele produzida é
A) 1350 W.
B) 500 W.
C) 2100 W.
D) 250 W.
E) 882 W.
Dado:
Aceleração da gravidade local = 10 m/s².
QUESTÃO 24
FGV-SP: Um elétron e um pósitron, ambos em repouso e próximos um do outro, se aniquilam gerando dois fótons. Se um dos fótons tiver quantidade de movimento  o outro terá quantidade de movimento
o outro terá quantidade de movimento  igual a
igual a
A) +ax̂+bŷ.
B) –ax̂–bŷ.
C) –ax̂+bŷ.
D) +ax̂–bŷ.
E) zero.
Dados:
Pósitron e elétron têm a mesma massa e cargas de sinais contrários.
a e b são constantes.
x̂e ŷ são, respectivamente, os versores paralelos aos eixos x e y.
QUESTÃO 25
FGV-SP: Um fio condutor cilíndrico, feito de um único material, tem uma parte A de comprimento L e seção transversal de raio a e outra, B, de comprimento 2L e raio 2a. As razões  respectivamente, entre as correntes e as tensões nas partes A e B do fio são:
respectivamente, entre as correntes e as tensões nas partes A e B do fio são:
A) RI = 1; RV = 2.
B) RI = 1; RV = 1.
C) RI = 2; RV = 1.
D) RI = 2; RV = 2.
E) RI = 1; RV = 4.
QUESTÃO 26
FGV-SP: Uma usina termoelétrica cuja eficiência da conversão de calor em trabalho é 55% queima 7200 kg de gás natural por hora.
O calor não utilizado na produção de trabalho aquece as águas de um rio de vazão igual a 4500 L por segundo. O aumento de temperatura da água do rioque passa pela usina é
A) 9,0 °C.
B) 5,5 °C.
C) 1,0 °C.
D) 2,5 °C.
E) 6,5 °C.
Dados:
A queima de 1 kg de gás natural gera 50.000 kJ de energia.
Calor específico da água = 1 cal/g °C.
1 cal = 4 J.
Densidade da água = 1 g/cm³.
QUESTÃO 27
FGV-SP: Um fio muito longo, perpendicular a esta página, é percorrido por uma corrente constante, entrando no papel. Quatro bússolas estão próximas ao fio, no plano desta página. A configuração que melhor representa a situação é


QUESTÃO 28
FGV-SP: Um gás ideal sofre a transformação ABCDA representada no diagrama pressão P x volume V, mostrado abaixo. O trabalho realizado pelo gás, o calor por ele recebido e a variação de sua energia interna são, respectivamente,
A) 560 J, 140 cal, zero.
B) 130 J, zero, - 130 J.
C) 260 J, 65 cal, zero.
D) 260 J, zero, -260 J.
E) 560 J, - 140 cal, zero.
Dado:
1 cal = 4 J
QUESTÃO 29
FGV-SP: Em uma escola, uma sirene, em repouso, emite um som de 680 Hz para indicar o início das aulas. Um estudante atrasado corre em linha reta, se aproximando da sirene na escola, a uma velocidade de 28,8 km/h. A frequência do som da sirene que ele escuta é igual a
A) 738 Hz.
B) 664 Hz
C) 612 Hz.
D) 680 Hz.
E) 696 Hz.
Dado:
velocidade do som no ar = 340 m/s.
QUESTÃO 30
FGV-SP: Em um treino de salto à distância, um atleta de 70 kg corre com uma velocidade horizontal de 10 m/s e, imediatamente antes do salto, dá um empurrão contra o chão e, ganhando velocidade vertical, aumenta sua energia cinética de 560 J. A velocidade vertical adquirida pelo atletalogo após o salto é, aproximadamente,
A) 5 m/s.
B) 3 m/s.
C) 2 m/s.
D) 4 m/s.
E) 6 m/s.
QUÍMICA
QUESTÃO 31
FGV-SP: Analise a figura a seguir que representa esquematicamente energias envolvidas em uma reação química.
Das reações químicas representadas abaixo, a que está relacionada com a figura é a:
A) Pb (s) + ½ O2 (g) → PbO (s) ∆H = − A
B) 2 H2 (g) + O2 (g) → 2 H2O (l) ∆H = − B
C) 4 C (grafite) + S8 (rômbico) → 4 CS2 (l) ∆H = + B
D) 4 Fe (s) + 3 O2 (g) → 2 Fe2O3 (s) + A
E) CaCO3 (s) + A → CaO (s) + CO2 (g)
QUESTÃO 32
FGV-SP: O trítio é um dos isótopos do hidrogênio que apesar de ser raro na Terra, está presente em grande quantidade no Sol. Seu processo de decaimento ocorre com meia-vida de 12 anos, segundo a reação:
A massa, em gramas, de Hélio-3 produzida pelo decaimento de 1 mol de trítio após 24 anos é de:
A) 1,50
B) 0,50
C) 2,75
D) 2,25
E) 0,25
QUESTÃO 33
FGV-SP: Modelos atômicos foram propostos ao longo do tempo por diferentes cientistas e possibilitaram o entendimento da estrutura atômica, das propriedades dos átomos e das reações químicas no nível microscópico.
Sobre os modelos atômicos são feitas as seguintes afirmações:
I O modelo atômico de Dalton considerava a existência de partículas subatômicas.
II Rutherford introduziu a ideia de níveis de energia quantizados para os elétrons.
III No modelo de Rutherford-Bohr os elétrons só poderiam ocupar níveis específicos de energia.
Está correto o que se afirma em:
A) I, II e III.
B) I e II, apenas.
C) I e III, apenas.
D) II, apenas.
E) III, apenas.
QUESTÃO 34
FGV-SP: A eletrólise do cloreto de sódio dissolvido em água é a base da indústria de cloro e de álcali. Os produtos mais importantes desse processo são o cloro gasoso e o hidróxido de sódio.
2 NaCl (aq) + 2 H2O (l) → 2 NaOH (aq) + H2 (g) + Cl2 (g)
Quando, através desse processo, ocorre a produção de 800 kg de hidróxido de sódio, o volume produzido de cloro gasoso, medido nas CNTP, é de:
A) 2,24 x 10³ L
B) 448 L
C) 2,24 x 10⁵ L
D) 224 L
E) 4,48 x 10⁵ L
Dados: Massa molar (g.mol⁻¹) Na = 23, O = 16, H = 1
QUESTÃO 35
FGV-SP: Uma pesquisa realizada pelo Centro de Prevenção e Controle de Doenças, nos Estados Unidos, em 2015, mostrou que o vapor gerado pelos cigarros eletrônicos também pode causar inflamações pulmonares. Substâncias como a acroleína, presente neste tipo de vape, são danosas às moléculas que mantêm as células endoteliais unidas.
Adaptado de: socesp.org.br. Acesso em 25/07/2023.
A acroleína é um aldeído insaturado com 3 átomos de carbonos em sua cadeia e é classificada como altamente venenosa.
A fórmula molecular da acroleína é:
A) C3H6O
B) C3H6O2
C) C3H5O
D) C3H4O
E) C3H4O2
QUESTÃO 36
FGV-SP: O organismo humano apresenta determinada quantidade de gases oxigênio e nitrogênio dissolvidos no sangue, provenientes, principalmente, da respiração. (...) O nitrogênio é um gás inerte na quantidade absorvida e, liberada pelo organismo e em condições ambientes de temperatura e pressão, não causa nenhum efeito adverso. Podemos considerar, inclusive, que existe uma espécie de equilíbrio envolvendo a dissolução e a liberação de nitrogênio no sangue, que se mantém constante em condições ambientes.
N2(g) + sangue (l) ⇆ N2 (dissolvido no sangue)
Adaptado de: FONSECA, M.R.M. Completamente química:
físico-química, São Paulo: FTD, 2001.
Em uma atividade de condições hiperbáricas como mergulho em grandes profundidades ocorre uma alteração nesse equilíbrio, cuja consequência é:
A) aumento da concentração de N2 no sangue.
B) aumento da quantidade de N2 gasoso.
C) aumento da temperatura do corpo.
D) aumento da produção de sangue pela medula.
E) diminuição da constante de equilíbrio do sistema.
QUESTÃO 37
FGV-SP: Cãibras podem ser desencadeadas por diferentes fatores, como sedentarismo, falta de flexibilidade e deficiência de nutrientes, especialmente o magnésio. O magnésio é essencial para promover a saúde, pois trabalha com mais de 300 enzimas em diferentes processos e funções do organismo. Além disso, produz energia, proteínas, regula a glicose no sangue e contribui para a formação óssea, trabalhando em conjunto com o cálcio e a vitamina D.
Adaptada de: oglobo.globo.com.
Acesso em 12/08/2023.
Os metais alcalinos terrosos citados no texto apresentam a seguinte característica em comum:
A) Possuem um elétron na camada de valência no estado fundamental.
B) Formam íons negativos devido às suas altas energias de ionização.
C) Apresentam-se como cátions bivalentes nos compostos iônicos.
D) Estão localizados no mesmo período da Tabela Periódica.
E) Estabelecem ligações covalentes com o oxigênio.
QUESTÃO 38
FGV-SP: A mineração de ouro na Amazônia está associada a um grande problema: a utilização do mercúrio. O mercúrio é usado para separar o ouro de outros materiais, mas, devido à sua alta toxidade, constitui um grave problema ambiental.
Numa das etapas da obtenção de mercúrio para utilização nesse tipo de garimpo, ocorre a redução do HgO. Esse óxido é aquecido junto com carvão, que atua como agente redutor. O carvão retira o oxigênio do óxido de mercúrio, deixando mercúrio livre.
Se, nesse processo de redução do mercúrio, houver a transferência de uma carga de 10F (faradays), a quantidade máxima de mercúrio metálico obtido será de :
A) 50g
B) 250g
C) 400g
D) 500g
E) 1000g
Dados: Massa molar (g.mol⁻¹) Hg = 200
QUESTÃO 39
FGV-SP: O dióxido de enxofre é um conservante adicionado ao vinho para impedir o crescimento de bactérias e de leveduras. A reação de oxidação deste anidrido produz o trióxido de enxofre precursor do ácido sulfúrico. Esta reação ocorre na presença de dióxido de nitrogênio em duas etapas:

Sobre o processo de produção de trióxido de enxofre descrito, é correto afirmar:
A) O monóxido de nitrogênio acelera a velocidade da reação.
B) O dióxido de nitrogênio é o catalisador do processo.
C) A reação global do processo é SO2 (g) + NO2 (g) → SO3 (g) + NO (g).
D) A presença de dióxido de enxofre diminui a energia de ativação da reação.
E) A presença de dióxido de nitrogênio diminui a entalpia da reação.
QUESTÃO 40
FGV-SP: A bula de um novo medicamento para diminuir a pressão intraocular de pacientes com glaucoma apresenta as seguintes informações: “Solução oftálmica tópica com 0,024% m/v de latanoprosteno bunode - embalagem contendo 1 frasco de 5 mL. Cada 1 mL da solução oftálmicacorresponde a aproximadamente 30 gotas”.
A quantidade do princípio ativo em cada gota do medicamento é, aproximadamente:
A) 8,0 µg
B) 1,6 µg
C) 0,8 mg
D) 1,6 mg
E) 8,0 mg
QUESTÃO 41
FGV-SP: Atleta brasileiro do salto com vara, medalhista olímpico foi suspenso provisoriamente pela Unidade de Integridade do Atletismo por ter testado positivo para ostarina.
Adaptado de: ge.globo.com.
Acesso em 30/07/2023.
A ostarina é uma droga utilizada para aumentar a massa muscular cuja estrutura está apresentada a seguir:
Entre as funções orgânicas presentes na ostarina, estão:
A) amida, éter e cetona.
B) cetona, fenol e amina.
C) ácido carboxílico, álcool e fenol.
D) amida, álcool e éter.
E) amina, ácido carboxílico e éster.
QUESTÃO 42
FGV-SP: Engenheiros alemães estão desenvolvendo baterias de zinco que não apenas armazenam energia elétrica, mas também produzem hidrogênio.
O objetivo do projeto é desenvolver um sistema de armazenamento de hidrogênio recarregável eletricamente, que possa armazenar energia na forma de zinco metálico e transformá-la novamente em energia elétrica e hidrogênio quando necessário.
Partindo de um projeto de bateria já comprovado, que usa ânodos de zinco, os pesquisadores adicionaram a também comprovada eletrólise de água alcalina, criando uma tecnologia híbrida completamente nova, na qual, além de armazenar eletricidade, a bateria torna-se capaz de produzir hidrogênio sob demanda.
Na bateria, ocorre a produção de oxigênio molecular e zinco metálico durante a carga e óxido de zinco durante a descarga.
Sobre o funcionamento da bateria são feitas as afirmações:
I Durante a carga o oxigênio molecular é produzido por oxidação.
II Durante a carga o zinco metálico é produzido por oxidação.
III Durante a descarga o óxido de zinco é produzido por oxidação.
Está correto apenas o que se afirma em:
A) III.
B) I.
C) I e III.
D) II.
E) II e III.
QUESTÃO 43
FGV-SP: Além de nutritiva, a cenoura pode trazer um efeito de bronzeado ao corpo, como pregam as gurus de beleza do TikTok. Uma das influencers afirma em vídeo, com mais de 3 milhões de visualizações, que come até três cenouras inteiras por dia.
Mas afinal, funciona? A resposta é sim. Contudo, não exatamente como um bronzeado, mas criando um tom alaranjado na pele. Por trás da "mágica", está o betacaroteno, um pigmento carotenoide antioxidante, presente na cenoura que é convertido pelo corpo em vitamina A.
Adaptado de: oglobo.globo.com. Acesso em 10/08/2023.
Analise a reação de conversão do betacaroteno em vitamina A:
A tabela a seguir apresenta valores de energias das ligações:
Utilizando os valores das energias das ligações fornecidos na tabela, a entalpia envolvida na reação apresentada de transformação do betacaroteno em vitamina A, em kJ.mol⁻¹, é:
A) 672
B) 8
C) 5
D) 164
E) 331
QUESTÃO 44
FGV-SP: Uma mineradora da Noruega anunciou a descoberta de uma reserva gigante de rocha fosfática, capaz de suprir a demanda global de fertilizantes e carros elétricos pelos próximos 50 anos.(...) A rocha fosfática pode ser processada para se transformar em ácido fosfórico, usado em baterias de lítio-ferro-fosfato, que alimentam sistemas de energia solar e carros elétricos.
Acessado em 12/07/2023
No processo citado no texto, há formação de um ácido de fórmula:
A) H3PO4
B) HPO2
C) HPO3
D) H3PO3
E) H4P2O7
QUESTÃO 45
Leia o texto a seguir:
FGV-SP: A propriedade cicatrizante da própolis, assim como várias outras propriedades biológicas, está relacionada com flavonoides, éteres, ácidos fenólicos e outras substâncias. Em estudo comparado da propriedade cicatrizante de um creme de própolis com um de sulfadiazina de prata, foi demonstrado que os ferimentos tratados com própolis apresentaram menos inflamação e mais rápida cicatrização.
Lustosa, S. R. et. al. Própolis: atualizações sobre a química e a farmacologia. Rev. Bras.
Farmacoqn. 18 (3), 2008. doi.org
A composição química da própolis inclui muitos compostos, inclusive os flavonoides e os éteres, cujas estruturas estão representadas a seguir e que tem despertado o interesse dos pesquisadores.
As substâncias __________ e __________ são isômeros de posição e a substância __________ possui isômeros geométricos.
As lacunas devem ser preenchidas por:
A) Biochanina A, Calycosina, Elemicina.
B) Isolemicina, Elemicina, Biochanina A.
C) Isolemicina, Elemicina, Calycosina.
D) Elemicina, Calycosina, Isolemicina.
E) Biochanina A, Calycosina, Isolemicina.






















COMENTÁRIOS